南溪山医院检验科陈建林团队研究成果荣登中国科学院TOP期刊《Oncogene》
发布时间:2025-12-04来源:南溪山医院 阅读:近日,南溪山医院(广西壮族自治区第二人民医院)检验科陈建林检验医师团队与福州大学附属省立医院黄毅教授(导师)、厦门大学俞春东教授团队等合作,在国际权威期刊《Oncogene》(中国科学院一区TOP,IF=7.3)发表了题为“Cancer-derived fucosylated exosomal miR-6842-3p as a novel marker promotes ESCC angiogenesis and metastasis via the PTEN/AKT/mTOR/IRF1/CXCL10 axis”的最新研究成果。此项成果是南溪山医院医学检验科作为主要研究单位首次在国际老牌期刊上发表高水平研究论文,标志着医院在肿瘤糖基化外泌体领域的基础与临床方面取得新的突破,彰显了其团队的创新实力。
食管鳞状细胞癌(ESCC)是全球尤其是我国面临的重大公共卫生挑战,约占所有食管癌病例的90%。尽管诊疗手段不断进步,ESCC的预后仍不理想,患者5年生存率普遍低于20%。这一严峻现状凸显了实现早期诊断和开发靶向治疗策略的迫切性,以期改善患者生存结局。目前,液体活检已广泛应用于恶性肿瘤的筛查与预后评估,而外泌体因富含多种生物活性分子,已成为该领域的研究焦点。
糖基化是外泌体表面关键的特征性修饰。其中,岩藻糖基化—即通过岩藻糖基转移酶将岩藻糖残基添加至糖蛋白或糖脂上-作为一种功能至关重要的翻译后修饰,能够调控外泌体的稳定性、受体细胞识别及其外泌体内容物的递送效率。表面岩藻糖基化水平较高的外泌体,称为岩藻糖基化外泌体(FUC-Exo),已被证实是肿瘤进展中的重要调节因子。
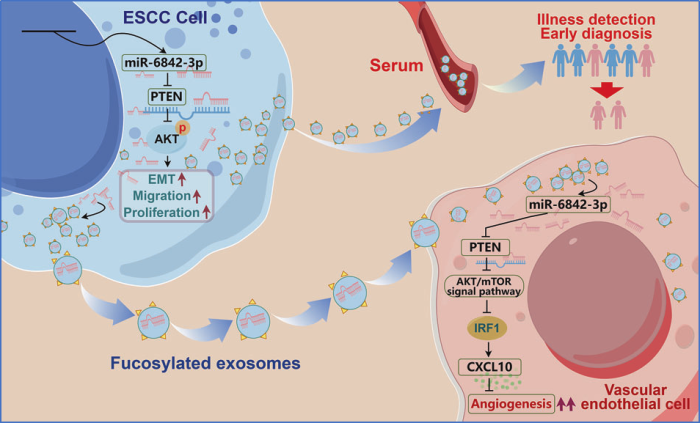
本研究基于团队前期发现,即ESCC患者血清FUC-Exo中miR-6842-3p表达显著上调。初步功能实验表明,外泌体来源的miR-6842-3p可促进ESCC细胞增殖、侵袭和迁移。然而,FUC-Exo递送的miR-6842-3p在肿瘤微环境重塑中的作用、分子机制及临床意义尚未明确。为此,本研究从临床样本分析、体外与动物实验以及分子机制探索三个层面系统开展研究。结果表明,血清FUC-Exo来源的miR-6842-3p是潜在的ESCC早期诊断生物标志物,其高表达提示患者预后不良。进一步研究发现,miR-6842-3p在ESCC中发挥致癌基因功能,可促进肿瘤生长、转移及血管生成。机制上,肿瘤来源的岩藻糖基化外泌体miR-6842-3p被HUVECs摄取后,能下调PTEN表达,进而促进AKT与mTOR磷酸化,并抑制IRF1的表达,最终降低CXCL10水平,驱动肿瘤血管生成。
综上,本研究阐明miR-6842-3p是ESCC生长、转移与血管生成的关键驱动因子。岩藻糖基化外泌体miR-6842-3p通过调控PTEN/AKT/mTOR/IRF1/CXCL10信号轴促进血管生成,凸显其作为ESCC新型生物标志物和治疗靶点的潜力。该研究不仅为ESCC早期诊断提供了新的液体活检标志物,也揭示了“岩藻糖基化外泌体-miR-6842-3p-PTEN-AKT/mTOR-IRF1-CXCL10”这一全新的促血管生成信号轴,为未来开发针对ESCC的靶向治疗策略提供了理论依据和潜在干预靶点。
该论文的通讯作者为福州大学附属省立医院黄毅教授和厦门大学俞春东教授(第二通讯作者)。共同第一作者为广西壮族自治区南溪山医院陈建林副主任检验医师,以及博士研究生吕祥和硕士研究生陈婧。陈建林团队长期致力于恶性肿瘤诊断模型构建及分子机制研究,聚焦于糖基化外泌体miRNA方向,相关研究成果已相继发表于《BMC Cancer》《BMC Medicine》《Journal of Experimental & Clinical Cancer Research》(JECCR)等中国科学院一区、二区TOP期刊。
广西壮族自治区南溪山医院检验科是自治区重点专科,也是一所集医疗、教学、科研与社会服务于一体的现代化区域医学检验中心。科室下设崇信院区与雁山院区两个标准化实验室,建立了涵盖临床生化检验、临床免疫学检验、临床血液与体液学检验、分子诊断、微生物检测等多领域的综合检验体系。科室拥有一支结构合理、稳定成熟的人才队伍,现有工作人员51人,其中正高级职称6人,副高级职称18人,中级职称14人;博士2人,硕士15人,本科29人,其中执业医师6名。作为桂北及湘南地区具有重要影响力的医学检验中心,科室依托自治区重点专科平台,始终秉承“精准检验、创新服务”的宗旨,形成了以分子诊断学精细化检验为特色、以微生物形态学检验为优势的学科格局,并构建了高通量、高精准度的现代化检验平台,为临床诊疗与疑难病例会诊提供了坚实的技术支持。
通讯员:邓承晓